Sayfa 3/30

NaClnin suda çözünmesinde, Na+ ve Cl- atomlarını bir arada
tutan örgü enerjisini yenmek için ısı gereklidir. Oluşan gaz haldeki Na+ ve Cl- iyonlarının etrafını H2O moleküllerinin sarması
hidrasyon enerjisidir ve ısı veren bir işlemdir. Çözeltinin entalpisi örgü enerjisi ile
hidrasyon enrijisinin toplamına eşittir. Sonuç olarak NaClnin suda çözünmesi 4
kJ/mol ısı almıştır.
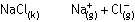
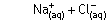
Katı NaCl kristali(1)
Hidratize olmuş iyonlar.(3)
Hidrasyon
enerjisi
Egzotermiktir.
(ısı veren)
Örgü enerjisi Endotermiktir. (ısı alan)
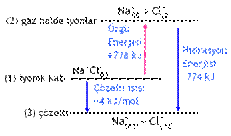
Çözünme olayını NaCl üzerinde inceleyelim.




NaClnin suda
çözünmesi
NaCl kristali
Cl‾ iyonunun
etrafını saran su molekülleriNa+ iyonunun
etrafını saran su molekülleriSonraki slayttaki animasyonu izleyiniz
Gaz halde
iyonlar.(2)