Sayfa 12/30

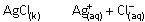
Herhangi bir andaki iyonların derişimleri çarpımına Qç dersek, bunu Kç değeri ile kıyasladığımızda çözünürlüğü
inceleyebiliriz. Çünkü Kç; çözünürlük dengesi değeridir ve doymuş çözeltideki iyonların
derişimleri çarpımıdır.
Çözününürlük dengesinin incelenmesi Qç ve Kç

Doymuş bir AgCl çözeltisinde Ag+ ve Cl- iyonları derişimi
biribirine eşittir. Çünkü mol oranları 1:1 . Bu çözeltiye AgNO3 eklediğimizde, AgNO3 iyonlarına ayrışacak, Ag+ ve NO3- iyonları oluşacaktır. Çünkü AgNO3 suda çözünen bir
bileşiktir.
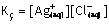
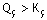

Kç belirli sıcaklıkta dengede olan doymuş çözeltideki
iyonların molar derişimleri çarpımıdır.
Kç Belirli sıcaklıkta dengede olan doymuş çözeltideki iyonların molar derişimleri çarpımıdır. İyonların derişimi çarpımı;
Kç değerinden az ise çözelti doymamış, Kç değerindeki çok ise
aşırı doymuştur.

İki farklı kaynaktan, yani AgClden
ve AgNO3den gelen Ag+ iyonları sebebiyle çözeltide Ag+ derişimi artacaktır. Ag+ derişimi Cl- derişimine eşit
olmayacak, Ag+ derişimi daha büyük olacaktır. Ag+ iyonlarının bir kısmı Cl- iyonları ile çökelti oluşturacaktır. Çözelti aşırı
doymuştur.
Qç >
Kç İyonların derişimi
çözünürlük derişiminden büyük olacaktır.

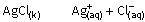

Benzer şekilde AgCl çözeltisine NaCl eklediğimizde Cl- iyonları derişimi
artacaktır.
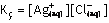

İyon derişimi çarpımı Kçyi aştığı anda çözelti aşırı
doymuştur ve çökelme başlar.