Sayfa 22/27





Kısmi Basınç, n-P İlişkisi
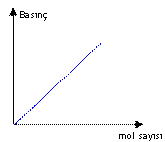
Mol sayısı arttıkça basınç
artar.
Mol sayısı ile basınç doğru
orantılıdır.
Diğer koşullar sabit iken bir
gazın mol sayısını arttırdığınızda basınç artar.
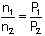
P1 ilk basınç, P2 son basınç
Bir gaz karışımının toplam basıncı, karışımı oluşturan gazların basınçları
toplamına eşittir.
Bu teori Dalton tarafından ileri
sürülmüştür.
n1 başlangıç mol sayısı, n2 son mol
sayısı
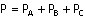
Karışımdaki gazlar mol sayıları ile orantılı basınç yaparlar.
Karışımdaki her bir gazın toplam basınca katkısı kısmi basınç olarak tanımlanır.
Toplam basınç
Karışımdaki
gazların basıncı

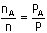
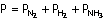
Azot, hidrojen ve amonyak
gazlarından oluşan karışımının basıncı her bir gazın basınının
toplamına eşittir.
Karışımdaki gazların toplam mol sayısı

Karışımdaki
A gazının mol sayısı
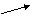
Karışımdaki
A gazının basıncı
Karışımdaki gazların toplam basıncı(karışımın basıncı)

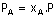


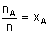
A gazının mol kesri.
A gazının mol sayısının toplam mol
sayısına oranı.
A gazının kısmi basıncı
(mol oranı ile basınç çarpıldı)