Sayfa 16/25

Bohr Teorisi
Bohr atom modeli:
1-Bir atomda her
elektron çekirdekten ancak belirli uzaklıklardaki yörüngelerde bulunabilir. Her yörünge
belirli bir enerjiye sahiptir. Bu yörüngeler enerji düzeyi veya kabuk diye adlandırılır.
n = 1,2,3,..
2-Yüksek enerji düzeyinde bulunan bir elektron düşük enerji
düzeyine inerse aradaki enerji farkına eşit enerjide ışın yayınlar.
3-Çekirdek çevresinde
dairesel yörüngeler izleyerek hareket eden elektronların açısal momentumları ancak
belirli değerler alır.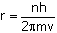

Bohr Teorisinin en önemli
yetersizliği:
Tek elektronlu sistemlerde
geçerlidir, çok elektronluları açıklamada yetersizdir.
Atom Modellerinin gelişimi için
Bohr elektronun çekirdeğe
düşmemesinin nedenini enerjinin kuantlaşması ile açıklamıştır. Kuantlaşmayı Hidrojen spektrumundaki n ile ilişkilendirmiştir.
-Bohr elektronun çekirdeğe
uzaklığını hesaplamıştır. (Bohr yarıçapı)
-Bir elektronun bulunduğu
yörüngedeki enerjisini hesaplamıştır.
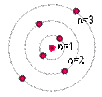
Bohr Atom Modeli
Bohrdan önce Dalton, Thomson ve Rutherfordun atom modelleri bilinmekteydi.
Rudherford (+) yüklü çekirdek etrafında boşluklar olduğunu ve (-) yüklü elektronların çekirdek etrafında döndüğünü
ileri sürmüştü.