Sayfa 17/25

Hidrojen atomunun çizgi spektrumunda, çizgiler arası uzaklığın
düzenli olarak küçüldüğü gözlenmiştir. Bohr, Hidrojenin çizgi
spektrumundan yola çıkarak atomdaki enerji düzeylerinin kuantlaştığını açıklamıştır.
n=1 enerji düzeyinde bulunan bir elektron enerji alarak bir üst
enerji düzeyine çıktığında, atom uyarılmış
haldedir. Bu
durum geçicidir. Kısa bir süre sonra elektron düşük enerji düzeyine geri döner. Bu atomun temel halidir.
Yüksek enerji düzeyinden
düşük enerji düzeyine inerken aradaki enerji farkına eşit enerjide ışın (foton)
yayılır.
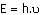
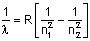
-Eşitlik tek elektronlu
sistemlerin (H, He+1, Li+2) spektrumunu açıklıyor, çok elektronluları açıklamada
yetersiz.
-Elektron
sonsuza giderse aradaki fark iyonlaşma enerjisi İE olur.
Balmer,
Rydberg
eşitliği
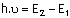
Bohr

Bohr teorisi ile Plank ve Einsteinin enerji eşitlikleri kullanılarak hidrojen gibi tek elektronlu sistemlerde enerji düzeyleri ve enerji
düzeyleri arası geçişte yayınlanan ışınlar sınıflandırılmıştır.
Enerji düzeyleri arası elektron geçişlerine bazı bilim adamlarının isimleri
verilmiştir., Lyman, Balmer, Paschen, Brackett, Pfund.
Enerji düzeyleri arası geçişler ve yayınlanan
ışınlarla ilgili daha fazla bilgi için sağdaki resme veya buraya
