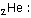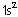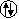Sayfa 23/25

Pauli ilkesi
Pauli Prensibi: Bir atomda aynı kuantum
sayısına sahip iki elektron bulunamaz.
En az bir kuantum sayısı
farklı olmalı. İki elektron içeren bir orbitaldeki elektronların spinleri biri
birine zıttır. (elektron çifti)n-baş kuantum sayısı
l-ikincil kuantum sayısı
m-manyetik kuantum sayısı (ml)
s-spin kuantum sayısı (ms)
Örneğin Helyumdaki iki elektron için düşünürsek;
n = 1
l = 0
m = 0
s = +1/2
1.Elektron için
(n,l,m,s) = (1,0,0,+1/2)
2.Elektron için
(n,l,m,s) = (1,0,0,-1/2)
n = 1
l = 0
m = 0
s = -1/2

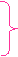
1.elektron
2.elektron
Hedeki iki elektronun spinlerinin farklı olduğu
görülür.
Aşağıdaki gibi de gösterebiliriz.