Sayfa 22/25

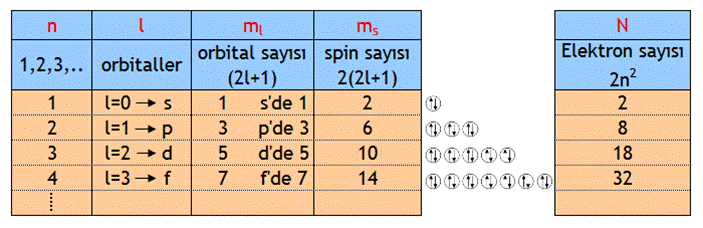
Baş kuantum sayısı: n= 1den başlar ve sonsuza
kadar gider. Birincil kabuktur.
Açısal kuantum sayısı: l=0dan başlayıp n-1e kadar
devam eder. İkincil kabuktur. Yörüngelerin şeklini belirler. s,p,d,f orbitalleridir.Manyetik kuantum sayısı: ml Elektronun çekirdek etrafında
hareketinden kaynaklanan manyetik alan kuantum sayısıdır. lye bağlıdır ve
lden +lye kadar değer alır. 2l+1 kadar değer alır. Örneğin l=1 ise m= 3 olur.
-1,0,1 değerlerini alır.
Spin kuantum sayısı ms, 1928de Dira tarafından geliştirilmiştir. Elektronun kendi ekseni etrafında dönmesinden
kaynaklanan manyetik alan kuantum sayısıdır. Elektronların spinleri +1/2
ve -1/2 şeklinde gösterilir. Bir orbitaldeki zıt spinli iki elektronu ifade eder.Ayrıca


Örnek:
1s
orbitali
n=1
l=0
ml=0 (1 değer)
Örnek:
2p
orbitali
n=2
l=1
ml=-1,0,1 (3 değer)
Örnek:
3d
orbitali
n=3
l=2
ml=-2,-1,0,1,2 (5 değer)

Örnek:
3s
orbitali
n=3
l=0
ml=0 (1 değer)