Sayfa 11/31

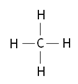

Elementlerin kovalent bağ sayısı yarı dolu orbital sayısı kadardır.
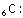
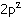
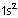
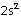
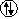

2

4
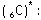
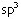
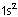

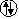

2

4
Temel Hal
Uyarılmış
hal
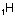
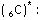
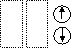

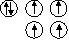
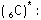
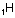
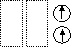
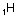
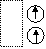
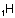

Orbitalleri gösterirken ok yönleri
spin i yani elektronların dönme yönünü gösterir. Zıt spinli
elektronlar bir araya gelebilir.
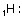
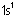

1
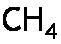

Bu şekilde de karşılaşabilirsiniz
iyonunda olduğu
gibi bazen boş orbitaller ile tam dolu orbitallerin çakışması ile de bağ olur. Bu
koordinatif bağlar olarak bilinir. (koordine
bağlar )
Aşağıdaki örnekte bir elektron vererek orbitalini
boşaltan H+ , Nnin 2s orbitali ile örtüşmüştür.
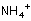
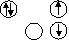
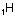
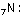
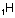

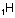
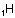


Diğer örnek: Al2Cl6 molekülünde Clnin yalnız elektron
çiftlerinin Alnin boş orbitalleri ile çakışması
sonucu koordinatif bağ oluşur.