Sayfa 38/38

Kimyasal Tepkimelerde
Denge Konu Özeti
-Denge; ürünlerin derişimi
ile girenlerin derişimi arasındaki bir orandır.
-Denge anında ileri
tepkimenin hızı, geri tepkimenin hızına eşittir.
-Denge anında
tepkime durmuş gibi gözükse de aslında durmaz, derişimlerde net değişme olmadığı için biz
durmuş gibi görürüz.
-Denge anı minumum enerji ile
maksimum düzensizliğin uzlaşma noktasıdır.
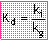
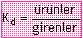
-Saf katı ve sıvılar denge
bağıntısında yer almaz.
-Ürünlerin mol
sayısı toplamı ile girenlerin mol sayısı toplamı aynı ise, basınç değişimi dengeyi bozmaz.



-Ürünlerin derişimi ile girenlerin derişimi arasındaki orana
bakarak, tepkimenin dengeye ulaşıp ulaşmadığını inceleyebiliriz. Denge anında Q = K
-Le Chatelier ilkesi: Dengede olan bir sistemin basıncı, sıcaklığı veya bileşenlerden birinin mol
miktarı
değiştirilirse, net reaksiyonun yönü bu değişikliğin etkisini azaltma
eğiliminde olacaktır.
-Denge sabitinin değeri sadece sıcaklık ile değişir. Sıcaklık
dengeyi bozar ve denge sabitinin değerini değiştirir. Derişim,
basınç-hacim değişmesi dengeyi bozar ancak denge yeniden kurulur.
Katalizör dengeye etki etmez, tepkimeyi hızlandırır.
-Tepkime bir sayı ile çarpılırsa, Kya üs olarak yazılır.
Tepkime ter çevrilirse, Knın çarpmaya göre tersi alınır. Tepkimler toplanırsa, Klar
çarpılır.