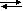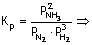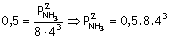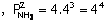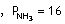Sayfa 13/38


Kısmi basınçlar türünden denge ifadesini kısaca aşağıdaki gibi
de açıklayabiliriz.
Karışımdaki gazların toplam basıncı(karışımın basıncı)
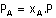
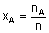
A gazının mol kesri. A gazının mol sayısının toplam mol sayısına
oranı.
A gazının kısmi basıncı



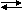
Tepkimesi için kısmi basınçlar türünden denge
ifadesi:
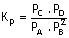
-Bir gazın
basıncı verilmişse, diğer gazların basıncı mol miktarlarına göre
bulunabilir.
-Gaz
karışımının basıncı verilmişse, her bir gazın kısmi basıncı bulunabilir.
-Kp verilmişse
basınçlar, Kd verilmişse derişimler hesaplanabilir.
-Kp ile Kd biribirine
dönüştürülebilir.
∆n 0dan farklı olan
tepkimelerde, basınç değiştiğinde dengenin bozulmasının sebebi, Le Chatelier
ilkesine göre, sistem değişen basıncı, karışımdaki gazların kısmi basınçlarını
değiştirerek karşı koyuyor. Kısmi basınçlar ise gazların mol
sayısı ile ilgili.
Örnek Reaksiyonunun denge sabiti
0,5 tir.
Dengedeki
Azotun kısmi basıncı 8, Hidrojeninki 4 atmosfer olduğuna göre, NH3ün kısmi basıncı kaç atmosferdir?