Sayfa 7/7

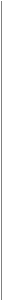
Cevap: B
1
Eşit mol sayısı
ve 14 lt kap önemli.
Tepkimeye giren
iki bileşikten 7 şer lt alınır.
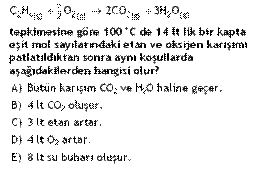
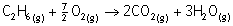
3,5
2
3
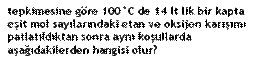

Tepkimelerde mol sayılarını üzerine yazarsak daha düzenli
olur ,işlem yapması da kolay olur.
1
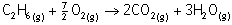

3,5
2
3
7 lt
7 lt
7 lt
2 lt
4 lt
6 lt
7 2 = 5 lt etan artar. Karışımdan artma var.
Başlangıçta
Bileşikler mol sayıları ile
orantılı hacimde tepkimeye girerler. Oluşan bileşiklerin hacimleri de
mol sayıları ile orantılı olur.Çünkü; eşit koşullarda
gazların hacimleri mol sayıları ile doğru orantılıdır. (Hacim oranları kanunu.
mol sayılarının iki katı hacim

Etan ile
oksijenin tepkimeye girme oranları;
1 mol /3,5 mol.
Eğer etanı 7 lt alsaydık, oksijeni 3,5.7= 24,5 lt almamız gerekirdi. O zaman oksijen yetmez
, kapta yetmezdi.
Bu nedenle az
olana göre işlem yapılır.
Gazların
cinsinin önemli olmadığı, ve mol sayıları oranında hacim
kapladıkları görülüyor.