Sayfa 5/7

Cevap: D
Kimyasal
Tepkimelerle ilgili hesaplamaların
1 mol üzerinden
yapıldığını hatırlayın. Bu nedenle 1 mol yani 16 gram CH4 ün yanmasından
açığa çıkan ısıyı kullanmalıyız.
3,2 gram CH4 0,2
moldür.
0,2 mol CH4 den 42,6
kkal açığa çıkarsa,
1 mol CH4 den 213
kkal ısı açığa çıkar.
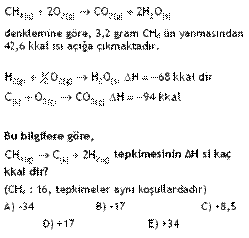
Bizden istenen
CH4 ün oluşum entalpisinin tersi
CH4 ün oluşum
entalpisini ise ilk tepkimede verilenleri yerine yazarak bulabiliriz.
Çünkü
bir tepkimenin entalpisi; ürünlerin entalpilerinden girenlerin
entalpileri çıkarılarak bulunabiliyordu.
Suyun ve
karbondioksitin oluşum entalpileri verilmiş. Elementlerin standart
oluşum entalpileri 0 idi.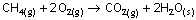
?
-94
kkal/mol
-68
kkal/mol
Standart halde elementlerin
oluşum entalpisi 0 olur.
0

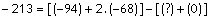
∆H = - 213 kkal/mol
Isı açığa çıktığı için
egzotermiktir, işaret (-) olur. Yanıltmasın..!




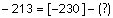
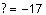
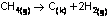
Bize sorulan ise bu tepkimenin tersi. İşareti
ters çeviririz. Çünkü bir tepkime yön değiştirdiğinde işaret ters
çevriliyordu.
CH4 ün oluşum ısısı -17 kkal/mol imiş.
∆H = + 17 kkal/mol
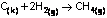
∆H = - 17 kkal/mol
